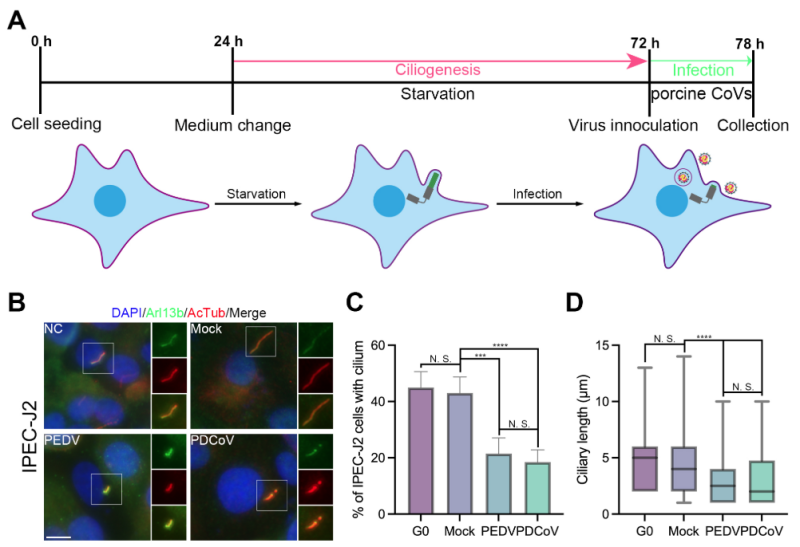
纤毛细胞器是存在于几乎所有真核细胞表面的一种天线样亚细胞结构,其清除运动是呼吸道的基本先天防御屏障。但近期有研究表明SARS-CoV-2可通过呼吸道纤毛穿过黏液屏障进入细胞实现感染,可见纤毛在病原感染中发挥多种作用和功能。因此,深入研究病毒感染对纤毛细胞器结构的影响及其互作机制对全面了解病毒的致病特性和宿主的先天防御具有重要意义。
近日,我院兽医学科研究人员在国际权威病毒学期刊《PLOS Pathogens》(医学/病毒学1区、TOP期刊)发表题为“Coronavirus M protein impairs cilium during early infection by enhancing the AurA-HDAC6 axis”的研究论文。该研究发现冠状病毒M蛋白是调控纤毛结构平衡的关键蛋白,系统解析了M蛋白通过调控Aurora 激酶 A(AurA)-组蛋白去乙酰化酶 6(HDAC6)通路从而介导纤毛去组装的分子机制,首次阐明了冠状病毒导致纤毛损伤的新机制。
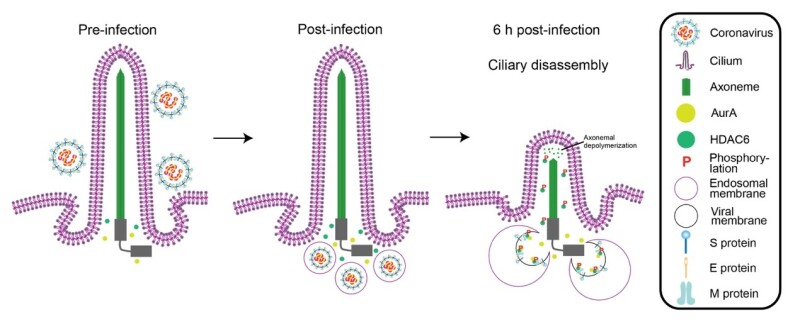
研究团队发现猪肠道冠状病毒(PEDV、PDCoV)感染猪小肠上皮细胞后导致纤毛细胞百分比显著减少,从40%以上下降到20%以下,纤毛长度从平均约4-5 μm变短到约2 μm,引起了明显的纤毛结构变化,导致纤毛损伤。进一步研究发现病毒感染通过激活AurA及其下游HDAC6,促进纤毛微管去乙酰化和纤毛去组装。通过降低AurA和HDAC6的mRNA表达水平或抑制蛋白活性均可有效阻止猪肠道冠状病毒感染引起的纤毛损伤。
深入研究发现,分属于冠状病毒四个属的PEDV(α)、SARS-CoV-2(β)、IBV(γ)和PDCoV(δ)的M蛋白均可以与AurA和HDAC6结合,并利用分子对接等技术鉴定出M蛋白结合AurA和HDAC6的关键氨基酸位点。研究图队发现结合位点在各个冠状病毒间高度保守,这些位点的突变则导致M蛋白与AurA或HDAC6的结合减弱,从而相应地降低突变体M蛋白对纤毛结构的调控能力。
综上所述,该研究首次从纤毛细胞器角度解析了冠状病毒新的致病机制,发现了M蛋白通过AurA-HDAC6通路轴在冠状病毒感染早期介导纤毛去组装的关键作用。更重要的是,研究发现M蛋白是冠状病毒造成纤毛损伤的重要毒力因子,为冠状病毒病的新型疫苗和抗病毒药物研发提供了新靶点,具有重要的意义。
论文的第一作者为免疫所动物疫苗抗原制备创新团队的庄腾寒助理研究员,兽医所动物腹泻病防控创新团队李彬研究员和免疫所冯磊副研究员为论文的共同通讯作者。该研究得到国家重点研发计划、国家自然科学基金、江苏省重点研发计划、江苏省自然科学基金和江苏省农业科技自主创新资金等项目资助。